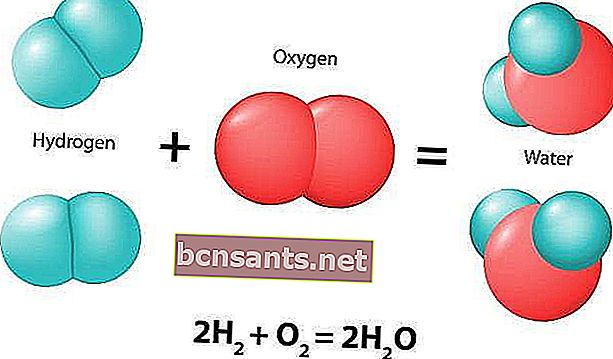
Химическая реакция - это естественный процесс, который всегда вызывает изменения в химических соединениях. Исходное соединение или соединения, которые участвуют в реакции, называются реагентами.
Химические реакции обычно характеризуются химическим изменением и приводят к одному или нескольким продуктам, характеристики которых обычно отличаются от характеристик реагентов. Вот пример химической реакции:
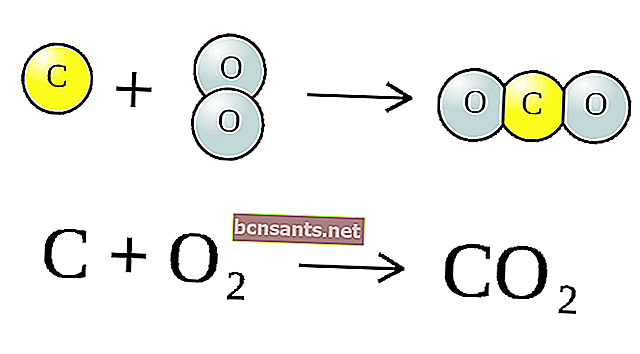
Вышеупомянутая химическая реакция представляет собой молекулу (CO2), состоящую из одного атома углерода (C) и двух атомов кислорода (O) плюс один углерод (C), с образованием 2 атомов окиси углерода (CO).
Комбинация этих символов называется химическим уравнением . Вещества слева от стрелки называются перреакциями (CO2) и C, а после стрелок называются продуктами реакции, а именно CO.
Характеристики химической реакции
Химические реакции в реальном мире очень легко обнаружить, например, при сжигании бумаги. Исходная бумага все еще имеет вид белого листа, после сжигания на огне цветная бумага сгорает.

Кроме того, когда мы кипятим воду. Следующая жидкая вода становится газом и водяным паром после кипячения в кастрюле, поставленной на плиту.
Эти явления являются признаками настоящей химической реакции. Однако для формирования продукта результат увидеть очень сложно. Вот характеристики химической реакции:
1 . Обесцвечивание
Химические молекулы / соединения обладают способностью поглощать цвета и излучать цвет в зависимости от веществ. На эту способность также может повлиять событие.
Например: реагенты железа, которые остаются на открытом пространстве слишком долго и во влажном состоянии, ржавеют (коричневато-желтые).
2. Изменение температуры
Химические молекулы / соединения обладают внутренней энергией в виде химических связей. Эти связи требуют энергии или могут выделять энергию.
Когда образуется много связей, энергия выделяется при повышении температуры. Например: сжигание сжиженного нефтяного газа на плите.
3. Появление пузырьков газа.
Газы в химических реакциях могут возникать из-за нагрева.
Например: молекулы / соединения пищевой соды в тесте при нагревании выделяют газ, так что пирог расширяется.
4. Изменение объема
Когда образуются продукты химической реакции, это означает, что объем реагентов уменьшается. Например: летом объем воды в озере уменьшается.
5. Образовавшийся осадок
Осадок - это остаточная химическая реакция между двумя растворами, которая становится твердой. Это вещество может появиться из-за слишком насыщенного раствора.
Например: раствор нитрата серебра (AgNO3) добавляется к раствору, содержащему хлорид калия (KCl), образуется белый осадок хлорида серебра (AgCl).
6. Светоизлучающий
Химические реакции иногда выделяют энергию в виде света.
Например: реакция на солнце.
7. Изменения проводимости.
Химические реакции влияют на изменение проводимости (способность проводить тепло).
8. Изменение вкуса
Химическая реакция при жевании риса создает сладкий вкус, когда он касается языка.
Факторы, влияющие

Скорость реакции или скорость химической реакции определяет количество химических реакций, которые происходят в единицу времени.
На эту скорость влияют несколько факторов, которые могут ускорить или замедлить процесс реакции. Вот факторы.
1. Измерение реагентов
Крупная соль или еще кусочки соли. Эта крупная соль довольно медленно растворяется в воде из-за своего большого размера. Так что химическая реакция очень зависит от размера вещества.
Также прочтите: Спрос и предложение - определение, законы и примеры2. Температура
Температура может влиять на химические реакции, а именно нагревание. Например, летом древесные леса горят быстрее, чем в сезон дождей.
3. Катализатор
Катализатор - это вещество, которое увеличивает скорость химических реакций при определенной температуре, не претерпевая изменений и не расходясь в ходе самой реакции. Ферменты - это один из типов катализаторов. Без ферментов эта реакция была бы слишком медленной для метаболизма.
Например, фермент мальтаза превращает мальтозу (тип полисахарида или сложного сахара) в глюкозу. Ниже представлена общая схема каталитических реакций, где C представляет собой катализатор:
А + С → АС (1)
В + АС → АВ + С (2)
Этапы химической реакции
Стадии реакции можно легко разделить на:
- Прекращение связи,
- Образование переходных соединений
- Образование облигаций
Для бимолекулярных соединений стадии более сложны из-за элементарной реакции.
- Стадия инициирования реакции
- Прекращение связей
- Образование переходных соединений
- Формирование продукта
- Стабилизация энергии (путем поглощения или высвобождения энергии / обычно тепла)
Разное
Химические реакции очень разнообразны, но их можно разделить на несколько типов, а именно:
1. Реакция на слияние
Реакция двух веществ, которые вместе образуют новое вещество. Простой пример - образование соли NaCl: 2Na + Cl2 → 2NaCl
2. Реакция разложения.
Соединение, возникающее в результате химической реакции, распадается более чем на два вещества. Примером может служить разложение воды H2O: 2H2O → 2H2 + O2
3. Единичная реакция обмена
Реакция обмена - это реакция, в которой элемент взаимодействует с соединением, чтобы заменить элементы, содержащиеся в этом соединении. Например, если окунуть медь в раствор нитрата серебра, образуются металлические кристаллы серебра. Уравнение реакции:
Cu (s) + 2AgNO 3 (водн.) → 2Ag (s) + Cu (NO 3 ) 2 (водн.)
4. Множественные обменные реакции.
Обычно называется реакцией метатезиса, это реакция частичного обмена реагентов. Если реагент представляет собой ионное соединение лауртана, заменяемые части представляют собой катионы и анионы соединения. Например, реакция кислот с такими основаниями, как:
HCl (водн.) + NaOH (водн.) → NaCl (водн.) + H 2 O (l)
5. Реакция горения
Эта реакция может быть известна как реакция перегруппировки атомов. Обозначен один из реагентов - кислород.
То есть реакция горения - это химическая реакция вещества с кислородом, обычно протекающая быстрее с выделением тепла, пока не появится пламя. Например сжигание метана
CH 4 (г) + 2O 2 (г) → CO 2 (г) + 2H 2 O (г)
Примеры химических реакций
В реальной жизни можно встретить так много реакций. Некоторые из них являются преднамеренными в форме практических занятий в лаборатории, так что это происходит естественным образом.
Некоторые из этих химических реакций могут включать реакции включения в новые продукты, горения, разложения и другие. Вот некоторые общие реакции:
1. Образование мыла

Реакция саженца представляет собой реакцию гидролиза жира / масла с использованием сильного основания, такого как NaOH или КОН, с образованием глицерина и солей жирных кислот или мыла. NaOH используется для производства твердого мыла, а КОН используется для производства мягкого или жидкого мыла.
Разница между твердым и мягким мылом, если судить по их растворимости в воде, заключается в том, что твердое мыло менее растворимо в воде по сравнению с мягким мылом. Реакция омыления также называется реакцией омыления.

2. Кислотно-основная реакция на соль.
Также прочтите: 4 принципа географии и их применение в нашей жизниВ химии соль - это ионное соединение, состоящее из положительных ионов (катионов) и отрицательных ионов (анионов), образующее нейтральное соединение (без заряда). Соль образуется в результате реакции кислот и оснований. Соль также может быть образована из двух разных солей, таких как:
Pb (NO 3 ) 2 (водн.) + Na 2 SO 4 (водн.) → PbSO 4 (т.) + 2 NaNO 3 (водн.)
3. Коррозионная реакция
Коррозия - это повреждение металла из-за окислительно-восстановительных реакций между металлом и различными веществами в его окружающей среде, которые образуют нежелательные соединения.
В процессе коррозии железо (Fe) действует как восстановитель, а растворенный в воде кислород (O2) действует как окислитель. Уравнение реакции образования ржавчины следующее:
Fe ( s ) → Fe2 + ( водн. ) + 2e–
O 2 ( г ) + 4H + ( водн.) + 4e– → 2H 2 O ( л )
4. Фотосинтетические реакции.
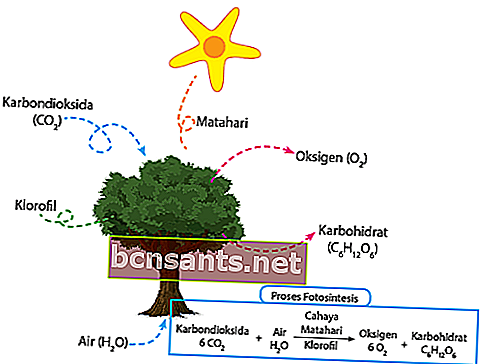
Согласно KBBI, процесс фотосинтеза - это зеленое растение, которое использует солнечный свет для преобразования воды и углекислого газа в углеводы. Углекислый газ, окружающий растение, напрямую всасывается тканью устьиц листьев. Вода, которая находится вокруг растения, напрямую впитывается корнями и передается к листьям через стебли растений.
Ровно в полдень падающий свет напрямую улавливается хлорофиллом для фотосинтеза. Уловленная ранее энергия солнечного света напрямую преобразует воду в кислород и водород.
Наконец, произведенный водород будет напрямую объединяться с двуокисью углерода для производства продуктов питания для нужд этих растений. Остальной кислород будет выделяться прямо в воздух через устьица. Вот химическое уравнение:
6CO2 + 6H2O + свет = C6H12O6 + 6O2
5. Химические реакции уксуса и пищевой соды.
Вас когда-нибудь рассказывали о химической реакции, если уксус и пищевая сода могут вызвать извержение игрушечного вулкана в вашей школе?
Кислые соединения, смешанные с щелочными соединениями, образуют нейтральные соединения. В эксперименте соединение слабой кислоты смешивали в растворе уксусной кислоты (CH3COOH) с соединением сильного основания в растворе пищевой соды (NaHCO3).

В химической реакции одно или несколько веществ могут быть преобразованы в новые вещества. Согласно эксперименту, кислый уксус (CH3COOH) реагирует с пищевой содой (NaHCO3) с образованием газа CO2.
Если кислый уксус (CH3COOH) и пищевая сода (NaHCO3) вступят в реакцию, это приведет к образованию пузырьков, вызывающих образование газообразного диоксида углерода (CO2). Эти газы и жидкости вызывают выход таких жидкостей, как лава.
6. Ферментативные химические реакции
Ферменты - это биомолекулы в виде белков, которые действуют как катализаторы (соединения, которые ускоряют процесс реакции, не вступая в реакцию полностью) в органической химической реакции.
Хотя каталитическое соединение может измениться в начальной реакции, в конечной реакции молекулы катализатора вернутся к своей исходной форме. Ферменты работают, реагируя с молекулами субстрата с образованием промежуточных соединений посредством органической реакции, которая требует более низкой энергии активации, так что химические реакции ускоряются, поскольку химические реакции с более высокими энергиями активации занимают больше времени.
Например: фермент каталаза - это фермент, который катализирует реакцию, в которой перекись водорода расщепляется на воду и кислород.
