
Периодическая система элементов - это система, которая представляет химические элементы. Обычно периодическая система элементов оформляется в виде таблиц.
Расположение периодической системы элементов основано на атомных номерах, электронных конфигурациях и химических свойствах.
Ниже приводится расположение периодической системы элементов:
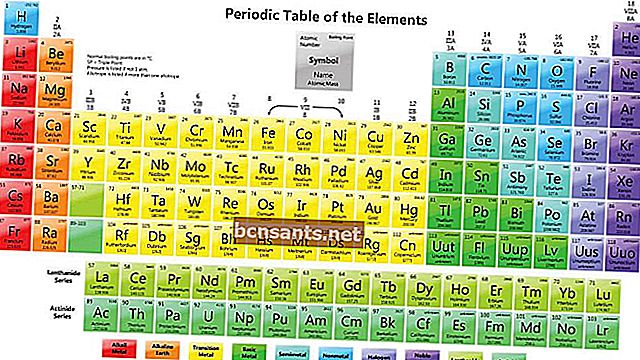
Как читать элементы в периодической системе элементов
В SPU вы найдете написание каждого элемента, как показано ниже.
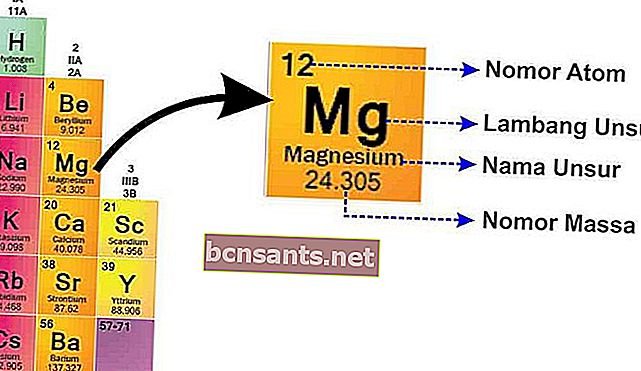
Из этого рисунка можно объяснить:
- Массовое число
Массовое число - это ядро атома, которое имеет положительный заряд, потому что есть протоны , которые заряжены положительно.и нейтроны, которые нейтральны
- Атомный номер
Атомный номер сообщает вам количество протонов, поскольку атом нейтрален, атомный номер также сообщает вам количество электронов .
Группировка элементов
В периодической системе элементов каждый элемент сгруппирован соответственно
- Группа
Группы находятся в вертикальном столбце периодической системы элементов. Элементы, находящиеся в одной группе, будут иметь одинаковую конфигурацию валентных электронов.

- Период
Периоды - это элементы, расположенные в горизонтальной строке периодической системы элементов. Период показывает энергию ионизации , атомный радиус, сродство к электрону и электроотрицательность.

- Блокировать
Блок представляет собой набор элементов, которые имеют одинаковую подоболочку валентных электронов.

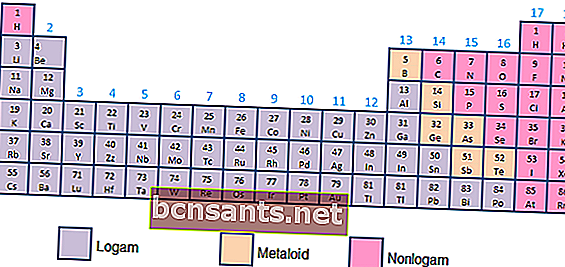
- Металлы, металлоиды и неметаллы
В зависимости от химических и физических свойств элементы можно разделить на металлы (высокая проводимость), металлоиды (проводимость между металлами и неметаллами) или неметаллы (не обладающие свойствами проводимости, в виде газов).
Энергия ионизации, атомный радиус, сродство к электрону и электроотрицательность
Энергию ионизации, атомный радиус, сродство к электрону и электроотрицательность можно увидеть на основе периодов и групп элементов в элементарной системе.
Читайте также: Как вы опознаете тела жертв авиакатастроф?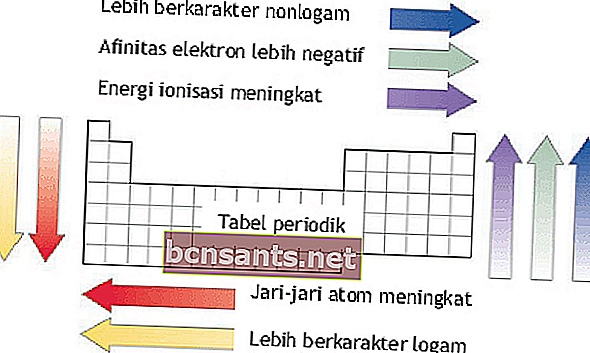
Энергия ионизации
Энергия ионизации - это энергия, необходимая для удаления одного внешнего электрона из атома в газообразном состоянии.
За один период энергия ионизации увеличивается слева направо по мере увеличения атомного номера.
Внутри группы энергии ионизации снижаются сверху вниз по мере увеличения атомного номера.
Радиус атома
Атомный радиус - это расстояние от ядра атома до самой внешней траектории атома.
За один период атомный радиус увеличивается сверху вниз.
Внутри группы атомный радиус увеличивается справа налево.
Электронное сродство
Сродство к электрону - это энергия, выделяемая атомом в газообразном состоянии для образования отрицательных ионов.
За один период сродство к электрону увеличивается снизу вверх. Внутри группы сродство к электрону увеличивается слева направо.
Электроотрицательность
Электроотрицательность - это величина склонности атома притягивать электроны при образовании химических связей. Это свойство важно при образовании связей между атомами.
За один период электроотрицательность увеличивается снизу вверх.
За один период электроотрицательность увеличивается слева направо.
Справка
- Периодическая таблица элементов
- //www.studiobelajar.com/sistem-periodic-elements/
